 2018-02-24
2018-02-24  7442
7442
天然气中含有H2S,是有害物质,它的存在一方面引起设备与管道腐蚀、催化剂中毒,另一方面严重的影响人身安全,是必须消除的污染物。目前,天然气脱硫技术开发了许多方法,硫化氢是无色气体、有刺激性恶臭、易挥发,燃烧时呈蓝色火焰。硫化氢是大气的主要污染物之一,不仅危害人体健康,还会严重腐蚀设备等。硫化氢治理开始较早,1809年英国克莱格使用石灰乳净化器脱硫,1849年英国兰宁和希尔斯获得干式氧化铁法专利,1870 年美国发展了氧化铁制备方法,年代山式钢化铁法在脱硫领域沿用100年之久。20 世纪30 年代一40年代出现溶液法,将氢氧化铁悬浮在碱液中进行脱硫;50 年代起,西欧普遍采用氨水法;60 年代出现砷碱法,用砷化物作催化剂。因砷化物有剧毒,逐渐为无毒催化剂所取代。如对苯二酚法、A.D.A.法、富玛克斯法、达克哈克斯法等都使用无毒催化剂,这些方法都是近年发展较快的技术。此外,溶液法的吸收废液处理技术也不断发展,形成了不同的脱硫工艺,主要有如下四类:
1.可再生溶剂吸收法
通过可再生溶剂吸收天然气中的H2S 是最常用的方法,含H2S 的天然气与溶剂通过逆流接触在吸收塔中将其脱除,同时吸收H2S 的副液通过再生将其除去,重新使用。再生出的酸气通过硫磺回收工艺将H2S转化成硫磺产品。常用的溶剂有化学溶剂、物理溶剂和混合溶剂。
1) 化学溶剂法
醇胺类化学溶剂是天然气脱硫最常见的方法,在低压控制中最适用,而且溶剂对烃的溶解度很小,不会造成烃的损失。醇胺法气体脱硫技术从溶剂生产、配制、配方、供应以及工艺技术咨询服务已专业化、商品化,如美国的联合碳化物公司、德国的巴斯夫公司等。主要是MODEA法,还有MEA、DEA、DIPA 等方法。脱硫效果是净化气中H2S 的含量由0.005%降到0.002%。
热碳酸钾法成功地应用到从气体脱除大量CO2 到用来脱除CO2
和H2S。
2) 物理溶剂法
使用物理溶剂进行天然气脱硫的过程没有化学反应发生,溶剂的循环过程主要是进料气量、吸收压力以及温度的函数。此外,大多数物理溶剂对H2S 均展示一定的选择脱除能力。缺点是:它对重烃的溶解度很大,重烃含量高的天然气不易使用。物理溶剂吸收法主要包括N 甲基吡咯烷酮法(Purisol 法)、聚乙二醇二甲醚法(Selexol 法)、磷酸三丁酯法(Estasovan 法)、N 甲基一已内酰胺法(NMC法)等。Purisol 法使用的溶剂是N 甲基吡咯烷酮( NMP),它沸点很高,对于H,S的溶解度很大,特别适用于有CO2存在的脱硫。Seled法使用的溶剂是聚乙二醇二甲醚,它同时脱去天然气中的CO2和H2S,对H2S的溶解度远远大于CO2,同时还有一定的脱水性。Estasolvan 法使用的溶剂是磷酸三丁酯(TBP),是德国Friedrich Unde 公司提出的用于脱硫和回收烃。TBP对H2S 比对CO2 更具选择性,可将天然气处理到管输标准。
3) 混合溶剂法
混合溶剂法是将物理溶剂与化学溶剂相混合,将化学溶剂获得软高处理气纯度和物理溶剂再生过程需热量较小相结合。同时,由于华理溶剂的参与使混合液在较高的酸气分压下有较高的酸气负荷力外,由于蒸汽压和溶剂降解引起的溶剂损失也很小但其价格较高。
2.固定床脱硫法
固定床脱硫法主要用于除去天然气低H2S 含量或痕量时的脱硫。整个过程是基于某些多孔介质的吸附特性而进行的,有时还将这些多孔介质用一些反应性的化学物质进行浸渍处理。这些过程一般都是应用于选择性H2S 脱除的。可再生脱硫剂有活性炭、活性氧化铝、硅股、合成沸石;不可再生脱硫剂有氧化锌。
1) 活性炭法

活性炭是最常用的固体脱硫剂,用来除去天然气中的微量H2S,优点是: 比表面和微孔发达、热稳定性好、在湿气中吸附率高、价格低、能吸收有机硫化物。吸收有机硫化物(硫醇、硫醚、CS2 、COS) 的活性炭其微孔数量比大孔多很多,平均孔径小于6nm。吸收无机硫化物的活性炭其微孔数量与大孔大致相同,平均孔径8mm- 20nm。脱硫后的活性炭用150℃-180℃的蒸汽再生,活性炭在150℃以上开始再生放出硫化物。用活性炭吸附硫化氢,通氧气转换成单体硫和水,用硫化胺洗去硫磺,活性炭可继续使用。此法不宜用于含焦油的气体。
2) 分子筛法

早在1958 年美国联合碳化物公司开始研究此技术,目前,已广泛用于脱除气体中的H2S 和其他硫化物。如合成沸石分子筛可用于天然气选择性脱除H2S 和其他硫化物。天然气中的硫化物比其他组分有更高的沸点和更大的极性,分子筛对极性分子的吸附选择性对硫化物产生高的容量。由于它对有机硫化物同对H2S一样具有很大的化学亲和力,所以,分子筛不仅除去H2S,而且对CS2、硫醇等也有很好的脱除效率,处理后的气体中硫质量分数下降至4×10-7。
3) 氧化锌法

氧化锌是用于脱除天然气中微量H2S 的有效脱硫剂,一般是做成球状体填充于固定床中,与硫化氢反应生成硫化锌和水,其反应不可逆,反应完全后重新装填硫化锌颗粒。此方法可将H2S 脱除到质量分数2×10-7。
4) 氢氧化铁法

将铁屑和湿木屑充分混合,加0.5% 氧化钙,制成脱硫剂,相对湿度为30%-40%。硫化氢同脱硫剂反应而被脱除,再生的氢氧化铁可继续使用。其反应如下:
2Fe( OH) + 3H2S ->FeS +6H2O
2FeS +6H2O +302 -4Fe(OH) +6S
此法脱硫效率高,适于净化硫化氢含量低的气体;但设备占地面积大,脱硫剂必须定期再生和更换,操作条件差。因而已逐渐为湿法取代,或同湿法联合用于深度脱硫。
3.直接转化法
该方法是将天然气中的H2S 转化成硫,并对硫回收,是一种脱除天然气微量H2S 的有效方法。直接转化法分混式氧化法和干法氧化法。
1) 湿式氧化法
此方法研究始于20 世纪20 年代,到现在已经有100 多种。其特点是:脱硫率高,净化后的气体中硫质量分数低于10-5( 13.3mg/m3)最高可达2 x 10-6;将H2S 转化成硫,无二次污染;可在常压下操作也可在加压下操作。Streford 氧化法是此方法的代表,目前应用较多。该工艺以矾作为脱硫的基本催化剂,采用意配-2,7- 二酸钠(ADA)做还原态矾的再生氧载体,洗液由碳酸盐做介质。
2)干法氧化法
此方法用于低含硫处理或气体精细脱硫,股前州铁法、其化快法和海绵铁法。
4. 膜分离法
在美国、加拿大儿家公司使用,利用丰适限分离天然气中的0和H2S。优点是方便灵话,易操作、运行费用低,缺点是膜的成本高。总之,脱硫方法很多,且有不同优、缺点,随着环境保护的加强,H2S脱除越来越被人重视,脱硫技术开发有广阔前景。
5.硫回收新技术
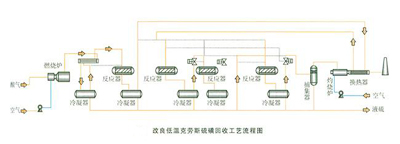
超优克劳斯工艺是荷兰Jacobs 公司的专利技术,具有超级克劳斯工艺的所有优点,不仅适用于现有的克劳斯装置改造,也适用于新建装置,在石化、石油、天然气行业国内也有数套超优克劳斯装置投人运行。从2007 年起,国内新建的数套煤化工装置都采用了超优克劳斯硫回收技术。陕西榆林天然气化工有限公司年产140 万1煤制甲醇资源综合利用项目中的五大关键生产技术之一—硫回收技术采用超优克劳斯技术,计划于2011年8月1日投料试车。此外,内蒙古天河化工有限责任公司年产100万煤制甲醇的一期工程年产60 万甲醇项目,也采用了超优克劳斯技术。陕西咸阳化学工业有限公司在陕西省威阳市东郊化工业园区内建设一套年产60 万1甲醇项目。含H2S的酸性气体进入硫磺回收装置界区,经过处理后酸性尾气达标排放到装置界区外,同时生产液态硫磺产品。华亭中煦煤化工有限公司年产60 万↑甲醇项目的硫黄回收技术,引进超优克劳斯技术。该项目的硫磺回收进料酸性气来自甲醇洗单元,酸性气中的COS 和H2S通过超优克劳斯技术加以脱除和回收,尾气中SO2 浓度能够完全满足小于550mg/m3的排放指标的要求。陕西延长石油集团年产20 万t醋酸及配套项目,是以煤炭为原料,选用美国德士古煤气化技术,甲醇洗装置的含H2S 酸性气体进人超优克劳斯硫回收装置处理,最终使得尾气中SO2 浓度低于国家排放要求。安徽淮化集团是安徽省最大的煤化工生产基地,在年产30 万t合成氨项目中合成气的净化采用低温甲醇洗工艺,从低温甲醇洗装置出来的含H2S 酸性气体成分为:
H2S 19.98%、CO2 75.926%、COS 1.997%、N2 1.993%、CH2OHO 104%。
通过减少甲醇循环量、较低再生压力、提高再生温度等措施,使酸性气体中的H2S 质量百分数提高到23% 以上,满足超优克劳斯工艺对进料气中H2S 质量百分数的要求,再进人超优克劳斯硫回收装置处理,装置的操作弹性20%— 145%,处理后的尾气达标排放。
目前,我国均采用传统的克劳斯工艺方法处理含H2S 的尾气,并回收硫磺。该方法只回收了硫化氢中的硫,其中所含的氢则在氧化过程中生成了水。石油精制过程所需的氢气都是由轻烃和天然气通过蒸汽转化而来的,从资源的综合利用方面,传统的H2S 回收工艺是对氢资源的浪费。为此,有效地回收石油脱硫加氢过程中所产生H2S 中的氢和硫就显得越加重要。下面是用热化学、电化学和光催化等H2S 分解制取硫和氢气的工艺路线进行了阐述,并对各种方法的特点进行了对比。品无政
1) H2S 分解制氢气和硫的方法
(1)直接高温分解。
H2S的直接高温分解是指无催化制存在的条件下,在商温护中加热H2S气体,使其分解的工艺过程,H2S的分解温度度一般高于800℃,分解反应为可逆反应,在某一温度下存在平衡浓度。
Helmer 等人进行了直接高温分解H2S 的试验,将H2S 气体通过一个850℃~ 1600℃的高温分解区,分解后的气体冷却至110℃~150℃,分离冷凝出硫,未分解的H2S 用有机胺吸收后循环使用。适宜的分解温度为900℃~ 1400℃,H2S 分解效率为10% ~ 40%。为了避免逆反应的发生,分解后的气体要快速冷却,应在0.15S 内将其冷却到800℃以下。Daley 等人则把H2S 气体通人装有耐高温材料的反应器,耐高温材料被预热到982℃~ 1816℃,通过两个反应器的切换达到热能的充分利用。Furhad 等人研究了在1000℃~ 1200℃范围内直接分解H2S 的工艺。以总压为0.1MPa 的H2S 和N2 或He 混合气为原料气,发现可以通过提高反应气流速来抑制H2 和S 生成H2S 逆反应,H2S 转化率随温度的升高和H2S 压力的下降而提高。在反应器内填充石英片可加快热量的传递,使H2S 在较短的停留时间里可达到分解平衡,H2S 的最高转化率可达65.8%。
(2) 催化热分解。
H2S 的热分解过程是一个强吸热反应,这在热力学上是不利的。在反应过程中加人催化剂,可以降低反应活化能,加试验上市用的催化剂为过世金属的氧化物和模化,.MOS2 等。
张谊华等人用不同的方法制备了几种硫化铁催化剂,研究了这些催化剂对H2S分解制取条气反应的催化性能。研究内容包括Fe2O3前驱物变为FeS的硫化过程和催化H2S 热解过程。结果表明,以机械混合的超细粒子a -Fe2O3 和Y-Al2O3 为催化剂前驱物,经过400℃的硫化过程制得的催化剂,其催化H2S 分解反应性能最佳。热解温度为300℃时,产氢率可超过10%。
Reshetenko 等人研究了在500℃~ 900℃ 温度范围内,以γ-Al2O3、а- Fe2O3 和V2O3 为催化剂,H2S 的非均相热分解反应。确定了γ-Al203 和V2O,催化H2S 分解反应的反应级数为2.0,而对а-Fe2O3 为2.6。有效活化能分别为72kJ/mol.94kJ/mol.103kJ/mol红外光谱分析结果表明,H2S 吸附在催化剂表面,先与表面氧形成氧硫化合物,之后进一步转化成单质硫。γ-Al203和а- Fe2O3 催化的热分解反应,产氢率可达到30%。
在低温条件下,H2S 热分解平衡时的氢含量是很低的,加人催化剂可降低反应的活化能,但不能改变化学平衡。在低于550C时,氢的平衡质量百分数1%,而在900℃时也只有13%。Badra将多孔的膜反应器应用于H2S 的催化热分解反应中,在温度低于700℃时,膜反应器无明显效果,随着操作温度的升高,膜反应器显示出较大的优势。这主要依赖于膜的选择性渗透性能( 只选择性地透过H2 分子)的发挥,使反应不断向着生成硫和氢的方向进行。里卡多以沉积于管状陶瓷多孔膜元件上的硫化钼为催化剂,利用一种具有单层多孔陶瓷膜式催化反应器将H2S 分解成硫和氢,并将产物分离。多孔陶瓷膜的特点是可以渗透氢,把氢直接从反应区域移出。在400℃~700℃、0.05MPa-0.1MPa 的反应条件下,处理质量百分数4% H2S 的混合气体,H2S 的转化率可达35%~56%。
Adesinat研究了以负载在Al2O3 上的钌-M 双金属硫化物为催化剂,在流化床中进行H2S 的分解,操作温度为883K- 1003K,操作压力为160kPa,其中Ru-Mo催化剂的催化性能优于其他5 种金属。研究表明,在流化床中H2S 的转化率高于相同操作条件下的固定床,但是仍非常低。
(3) 电化学分解。
电化学分解硫化氢是在电解槽中利用电化学的方法直接或间接电解H2S,从而得到硫和氢气。早期研究发现,直接电解过程中沉淀在电极表面的硫磺导致电极的钝化,电流减弱,后来的研究主要集中在开发间接分解H2S 的工艺。利用含三价铁离子的强酸性反应液氧化吸收H2S 与电解制H2 相结合,从H2S 中回收H2 和S得到了广泛的研究。那罗文利等研究了氧化吸收硫化氢反应与电解制氢相结合从硫化氢中回收氢气和硫磺的方法。氧化吸收H2S 的反应方程式为
2Fe3+ +H2S→2Fe2+ +2H+ +S
富含二价铁离子的氧化液采用微孔过滤器抽滤脱硫后,在电解反应器的阳极再生为富含三价铁离子的氧化液循环使用,同时在电解反应器的阳极析出氢气。电极反应:
阳极2Fe2+ -+2Fe3+ +2e
阴极2H+ +2e→ H2
总反应2Fe2+ +2H -2Fe3+ +H2 ↑
此及度的理论分解电(0.771V)要比水的理论分解电压(1.23V)低,因此此法制复可大幅降低电能的消耗。在试验条件下,H2S 的吸收率可达85%,电解制氢和氧化液再生反应能在低电压(1.2 V)下进行,氧化液可循环使用,阳极再生二价铁为三价铁的效率与阴极析氢效率均接近100%。
李永发等人在石油大学(华东)胜华炼油厂建立制氢规模为100L/h-120L/h 的扩大实验装置,处理含H2S 体积百分数为85%~95% 的尾气。现场放大试验表明: 由化学吸收和电解反应组成的双反应工艺处理炼厂含H2S 酸性气体是可行的。化学吸收过程适宜的操作条件为:吸收液含三价铁离子浓度大于2.5mo/L,操作温度为60℃,液气比(体积比)大于1.5,此条件下H2S 吸收率大于99%,所制得的硫磺纯度大于99.8%,其中单位立方米氢气的电耗约为2.9kW.h。
Petrov 和Srinivasan 根据硫在80℃时可溶解在pH= 14 的多硫化合物的溶液中,设计了一种可净化质量百分数10%~15% (炉) H2S 的天然气的工艺过程。首先用NaOH 溶液洗含H2S 的酸性气体生成NaHS,然后阳极氧化硫离子生成多硫离子,再将多硫化合物转移到电解池外的分离槽中,含H2S 的原料通过此槽,生成高纯的单质硫。电解池的分解电压为1.0 V,电流密度为300 mA·cm-2,经过长期测试,电池系数稳定。
(4) 光催化分解。在光催化反应体系中,可利用太阳能来光解H2S 生成H2 和S。在液相反应中,催化剂常为胶体半导体,如TiO2、CdS、CdSe、ZnS、ZnO、CuS、SrTiO3 等。在半导体粒子中,光引发电荷分离,产生电子一空穴对(激子),吸收的光能等于其禁带宽度,产生的电子一空穴对向表面迁移,使表面吸附的物质发生氧化还原反应,即
hυ Semiconductor→ ( CB) e- + (VB )h+
空穴把H2S 或HS- 氧化成S,即
2h+ +H2S-2H+ +S
电子把H↑还原成H2,即
2H+ +2e- →H2
Linkous 等人以450nm~50Onm 的可见光为光源,以Pt-CdS、ZnS、ZnFe2O4、In2S3; 为催化剂,通过光催化反应,分解H2S 生成氢气和硫。利用多硫化合物为循环液,在碱性条件下通过调节PH 值吸收H2S 和析出单质S。Naman 等人以TiO2、CdS 和CdSe 半导体悬浮物为催化剂,在含20%不同醇胺水溶液中进行H2S 的光分解生成H。试验表明,在60℃时,50 mg TiO2 悬浮在125ml、20% 甲醇胺水溶液中,氢气的产率最大,可达到3000μL/h。Bessekhouad 等人用不同的方法制备了适合太阳光谱的Bi2S3 催化剂,其禁带宽度为1.28eV,负载Pt 后,在500 W 的卤灯辐照4h,氢气产率为0.0213 mL/mg。
TiO2和ZnS 都是良好的光催化剂,但其带宽位于紫外区,因此限制了其量子产率。如果是两种半导体的混合,一种具有低的禁带能级(位于可见光区),而另一种具有较高的禁带能级( 位于紫外区),这种复合催化剂可有效地提高H2S 的分解效率。联系紧密的两种半导体可以增加粒子间的传递,有助于提高H2 的产率。Supiya 和Subrhmanyan研究cas -ZnS 双组分催化剂光催化分解H,S,确定了CdS与ZnS的最佳比例为1: 1,并且把CdS-ZnS( 1: 1)担载在碱性氧化物Li2O-MgO 上,表现出较高的光催化活性。当以质量百分数10%CdS-ZnS 负载在质量百分数30%Li2O 的Li2O- MgO 载体为催化剂进行反应时,产氢率可达316umol/h。SO 等人将纳米CdS 与TiO2 溶胶按不同的摩尔比机械混合,制备出一种CdS- TiO2 复合薄膜光催化剂,当TiO2 与( CdS +TiO2)摩尔比为0.8 时,产氢速率最高为0.76mL/(cm2·h)。
Kale 等人用固态反应和溶液路线合成出一种新的金属氧化物光
催化剂ZnBiVO4,并考察了其对H2S 的光催化分解活性,通过溶液路线合成的催化剂ZnBiVO4 比表面积为4.7m2/g,当在悬浮有1g 此催化剂的500mL 蒸馏水中每分钟通人10mL H2S 时,产氢速率为122 mL/h。
张谊华等人以V2Os/TiO2 为催化剂,在室温条件下将氧化钒硫化为硫化钒,发现紫外激光可诱导H2S 气体在硫化钒表面的裂解;辐照9min,产生氢气0.45 mL。而俞稼镛等人利用超声辐射在液一固界面引起的空化效应,用Cds 粉末为催化剂光解H2S,发现经超声辐射增强了多相光催化反应,提高了产氢率。10min 内光照和超声辐射协同作用要比单纯光照产氢量提高15.8 倍。
(5) 其他H2S 分解方法。Hysulf 非水液态氧化还原分解硫化氢制氢工艺是由美国Marathon 石油公司在20 世纪八九十年代开发的。此工艺是在极性有机溶剂n一甲基一吡咯烷酮(NMP)中进行的,H2S 先与苯醌反应生成相应的氢醒和硫,去除硫后,氢醌溶液混合物经催化过程生成氢和可以回收的苯醌溶液。
另外,马文等人研究了在微波作用下,以硫化亚铁为催化剂,将H2S 分解为氢和硫。在试验条件下,H2S 分解转化率达到了87.95%。在此方面,俄罗斯和美国合作研究了利用微波能产生等离子体分解H2S。
最近国外对克劳斯工艺的基本化学过程重新分析,提出了硫化氢催化部分氧化工艺。硫化氢部分氧化工艺采用硫化氢与氧之比为4:1(而不是传统克劳斯炉内的2: 1)酸性气体进行反应,硫、水和氢是主要反应产物。这就意味着当硫化氢的转化率达到100% 时,有50% 的硫化氢转化成氢。因此,国外的一些研究人员利用多孔介质超绝热燃绕技术来实现硫化氢自热分解成元素硫和氢。杜礼明等人综述了超绝热技术在硫化氢分解制氢上的应用。
2) 各种工艺路线的分析与比较
以硫化氢为原料制取氢气同时回收硫破,不但充分利用资源,获得了清洁的氢能,而且有利于环保,已受到了越来越多的重视。
(1) 直接高温分解法。在高温炉中直接高温分解H2S虽然在工业技术上相对较成熟,而且可处理高浓度的H2S 原料,但从能源消耗和经济方面考虑,在工业上采用常规的直接热分解是不可行的。从热力学数据分析可知,对于H2S 的气相分解反应:
2H2S→S2 +2H2
该反应为热力学不利的吸热反应,平衡转化率很低,因而要求有较高的反应温度,给工业应用带来困难。标准状态下反应的焓变为△H 0=171.6 kJ,熵变为△S0=0.078 k/K,吉布斯自由能变化为△G0=148.3 kJ,温度只有高于1811K时分解反应才能自发进行。H,S分解强烈依赖温度,只有在很高的温度下才有较高的分解转化率,很难实现工业化。此外,由于H2S分解转化率低,大量H2S需与氢气分离,在系统中循环,增加了能耗,降低了装置效率。
(2) 催化热分解法。催化热分解法尚处于实验室研究阶段,催化剂的研究仍是一个重点,但催化热分解同样要受到化学平衡的影响,产复率很低。随着膜技术的发展与应用,虽然可有效地把氢气从反应产物中移出,使反应不断向分解方向进行,但是目前陶瓷膜极限耐热温度为800C-920C,而热分解温度超过此温度,膜材料会遭到破坏。
(3) 电化学法。电化学法分解H2S 研究较早且工艺较成熟,以三氯化铁溶液为氧化液,利用化学吸收和电化学分解相结合的双反应工艺吸收H2S,H2S 吸收率大于99%,并且可以处理高浓度H2S 气体,在工艺技术上具有可行性和优势,每立方米氢气的耗电量为2.9kW.h,在经济上可望与克劳斯法相比。
(4) 光催化分解法。光催化分解法利用丰富且廉价的能源一太阳能,作为能量来源分解H2S 制取氢气。光催化反应条件缓和、耗能低,是较为经济的方法。如果开发出高活性的光催化剂以及合理的光催化工艺,本方法有可能成为硫化氢分解制氢的重点。目前,光催化分解法的研究借鉴光催化分解水的研究方法,主要集中在开发半导体光催化剂,与此相比,对有效的光催化反应器的研究则相对有限,因此设计合理的工艺路线和光反应器将会非常有价值。
(5) 其他方法。其他分解H2S 的方法,如Hysulf 工艺具有投资成本低、操作费用低等特点,但形成的硫的聚合和沉淀步骤是一个限制因素。将微波能、电场能等其他形式的能量引人反应,以及各种射线等形式能量的应用,大大改变了反应的状况,但此方法尚处于实验室研究阶段。超绝热燃烧技术应用于H2S 的分解制氢虽可最大限度地利用H2S,降低能量消耗,但反应要在1400K~ 1600K 条件下进行,对反应器的材质要求较高,将会增加反应设备的成本。
随着我国经济的不断发展,天然气及石油进口逐年递增,目前进口原油的量已超过1x 108t,而进口石油的硫质量百分数较高,按0.6%~2%计,每年可产生硫化氢气体60 x104 t~200x104 t。此外,我国酸性天然气中也含有硫化氢,因此有必要合理利用硫化氢资源。光催化分解硫化氢回收硫磺和氢气,由于是利用廉价的太阳能和缓和的反应条件,因此具有很高的研究价值和应用前景。

 当前位置:
当前位置:
 销售热线:13778063519
销售热线:13778063519 邮箱:jysongwei@126.com
邮箱:jysongwei@126.com 四川省江油市三合镇老君路
四川省江油市三合镇老君路

 QQ咨询
QQ咨询 电话咨询
电话咨询 在线留言
在线留言 分享
分享 返回顶部
返回顶部